Альдегиды
Характерной функциональной группой молекулы альдегида, определяющей его реакционную способность, является карбонильная группа (>С = 0).
Эта группа характерна также для молекул кетонов и сложных эфиров.
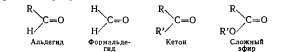
Исключение составляет формальдегид, в молекуле которого карбонильный атом углерода связан с двумя водородами.
В кетонах с карбонильным углеродом связаны две алкиль-ные группы (R и R'), а в сложных эфирах - одна алкильная, другая - алкоксильная группа (R'O-).
Все эти типы соединений, содержащие одну и ту же функциональную группу (карбонильную), имеют много общих свойств, общих реакций идентификации, обусловленных именно этой группой.
В свою очередь каждое из этих соединений имеет и частные, специфические реакции идентификации, отличающие их друг от друга.
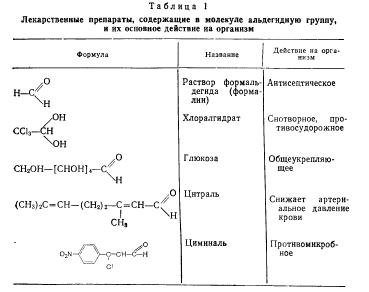
Физиологическое действие препаратов, имеющих в молекуле альдегидную группу, различно и зависит главным образом от характера алкильного остатка, связанного с карбонильным углеродом (табл. 1).
Удлинение алкильного радикала в молекуле альдегида приводит к усилению физиологической активности, но вместе с этим возрастает и токсичность.
Введение галогена в молекулу альдегида повышает его наркотическое (снотворное) действие. Так, наркотические свойства хлораля более выражены, чем у ацетальдегида.

Альдегидная группа усиливает токсичность вещества, но она может быть значительно снижена путем образования гидрат-ной формы альдегида.
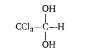
Способность к образованию гидратной формы проявляется лишь у хлорированного альдегида. Так, гидратная форма хлораля мало токсична, в такой форме хлораль применяется в медицине под названием хлоралгидрата, проявляющего снотнор-ное действие.
По физическим свойствам альдегиды могут быть газообразными (формальдегид), жидкими (низшие альдегиды) и нерастворимыми твердыми (высшие альдегиды) веществами.
Альдегиды хорошо растворяются в спирте и эфире. Низшие альдегиды имеют неприятный удушливый запах. Альдегиды с большой молекулярной массой обладают приятным цветочным запахом.
В химическом отношении альдегиды весьма реакционноспо-собные соединения, что обусловлено наличием в их молекуле сильно поляризованной двойной связи, за счет которой протекает большинство реакций, характеризующих химические свойства альдегидов. Многие из этих реакций, например образование оксимов, семикарбазонов и ряда других соединений, используются для качественного и количественного анализа лекарственных препаратов из группы альдегидов.
Из химических свойств альдегидов, лежащих в основе реакций их идентификации, необходимо отметить следующие:
1. Альдегиды легко окисляются, являясь сами хорошими восстановителями. Восстановительная способность альдегидов выражается следующими реакциями:
а) реакция с аммиачным раствором нитрата серебра (образование серебряйого зеркала); при добавлении к аммиачному раствору нитрата серебра раствора альдегида при нагревании

Применяя данные реакции в фармацевтическом анализе, надо учитывать их чувствительность. Так, для подтверждения подлинности препарата с альдегидной группой в молекуле следует применить реакцию с нитратом серебра и реактивом Фе-линга, а для обнаружения альдегидов как примесей в лекарственных препаратах следует применить более чувствительную реакцию (с раствором Несслера).
2. Реакции присоединения представляют интерес для фармацевтического анализа потому, что продукты присоединения альдегидов характеризуются определенной для каждого альдегида температурой плавления.
17А
Так, альдегиды легко присоединяют бисульфит натрия, образуя бисульфитные производные альдегидов - кристаллические вещества, имеющие определенную температуру плавления.
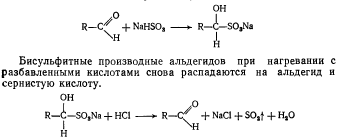
Бисульфитные производные альдегидов при нагревании с разбавленными кислотами снова распадаются на альдегид и сернистую кислоту.
Этой реакцией пользуются не только для определения подлинности препарата с альдегидной группой в молекуле, но и для очистки альдегидов и выделения их из смесей с другими веществами, не реагирующими с гидросульфитом натрия.
К реакциям присоединения относится также реакция взаимодействия альдегидов с фуксинсернистой кислотой1, при которой раствор окрашивается в красный или красно-фиолетовый цвет. При добавлении к реакционной смеси минеральных кислот окрашивание исчезает. Исключение составляет лишь формальдегид, в присутствии которого окраска не исчезает. Поэтому реакцию считают специфичной для формальдегида.
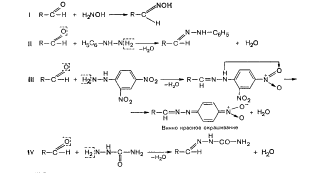
3. Реакции замещения - это реакции взаимодействия альдегидов с аминами и их производными, например с гидроксилами-ном (I), фенилгидразином (II), 2,4-динитро-фенилгидрази-ном (III), семиркарбазидом (IV) и др.
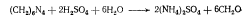
Продукты взаимодействия этих веществ с альдегидами выпадают в виде осадков и после высушивания имеют определенную температуру плавления или окраску (2,4-динитрофенилгид-разин), поэтому эти реакции используются для идентификации препаратов, имеющих в молекуле альдегидную группу.
Фармакопейными препаратами из группы альдегидов являются: раствор формальдегида (формалин), хлоралгидрат и глюкоза.
В этой группе лекарственных препаратов мы рассматриваем также гексаметилентетрамин, физиологическое действие которого обусловлено формальдегидом, выделяющимся в кислой среде при разложении гексаметилентетрамина.
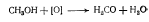
28.06.2015
